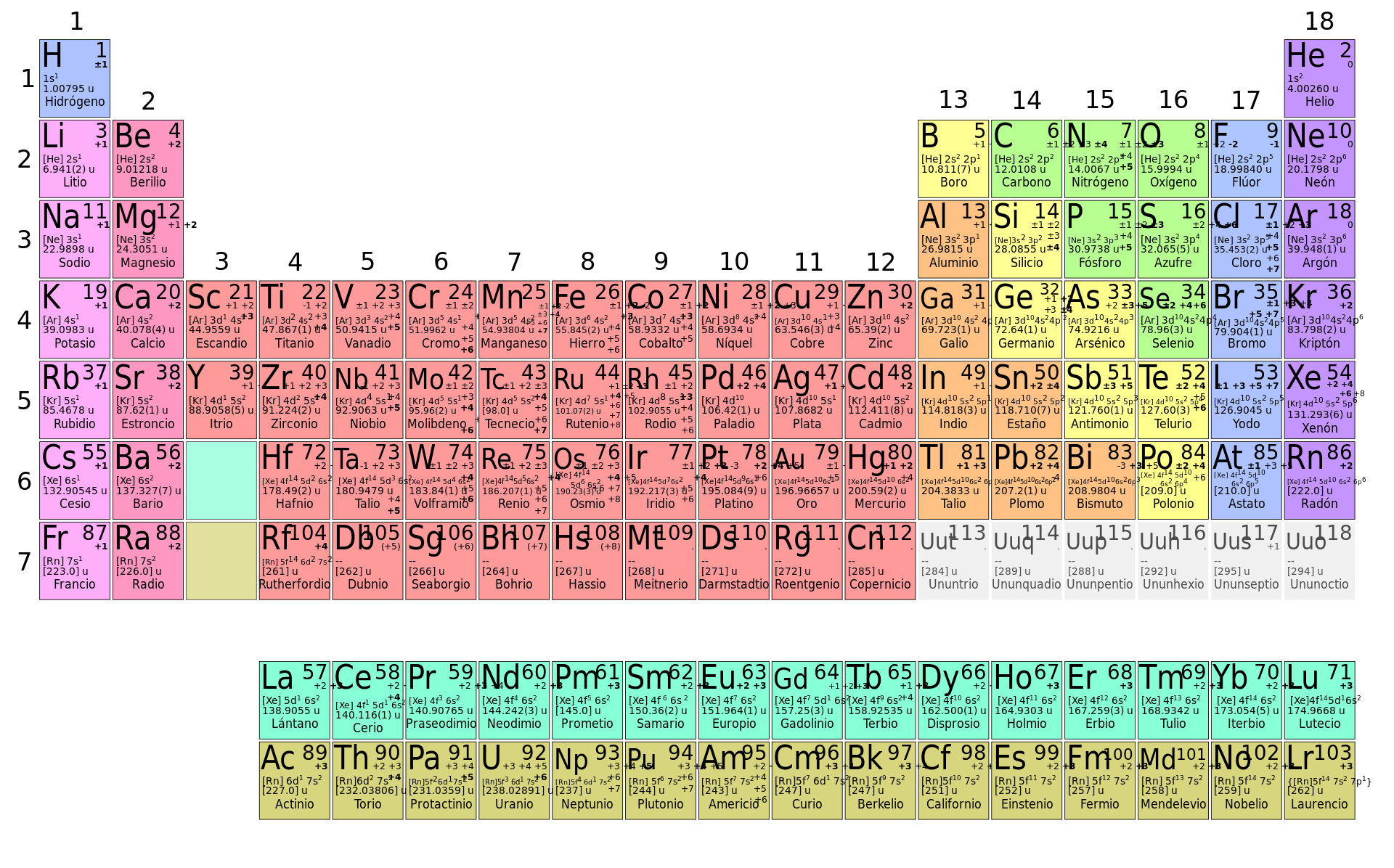
La taula periòdica, classifica els elements segons les seues propietats i característiques.
Per a tota persona interessada per la química, la taula periòdica és necessaria.
La taula periòdica es divideix en grups (columnes) i períodes (files). Està formada per 18 grups i 7 períodes.
Els grups, estan formats per elements amb propietats paregudes. Podem fer la distinció dels seguents grups:
- Metalls alcalinis
- Alcalinoterris
- Metalls de transició
- Metal·loides o semimetalls
- No metalls
- Gasos nobles
Els períodes s'ordenen segons el nombre atòmic.
La història de la taula periòdica, es relaciona amb diversos aspectes del desenvolupament de la física i la química:
- El descobriment dels elements de la taula periòdica
- L'estudi de les propietats comuns i la classificació dels elements
- La massa atòmica
- La relació entre la massa atòmica i les propietats periòdiques dels elements.
Actualment, es coneixen 118 elements diferents: uns 90 naturals i la resta s'han obtès en els laboratoris d'investigació, on encara, a dia de hui, estan intentan sintetitzar nous elements.